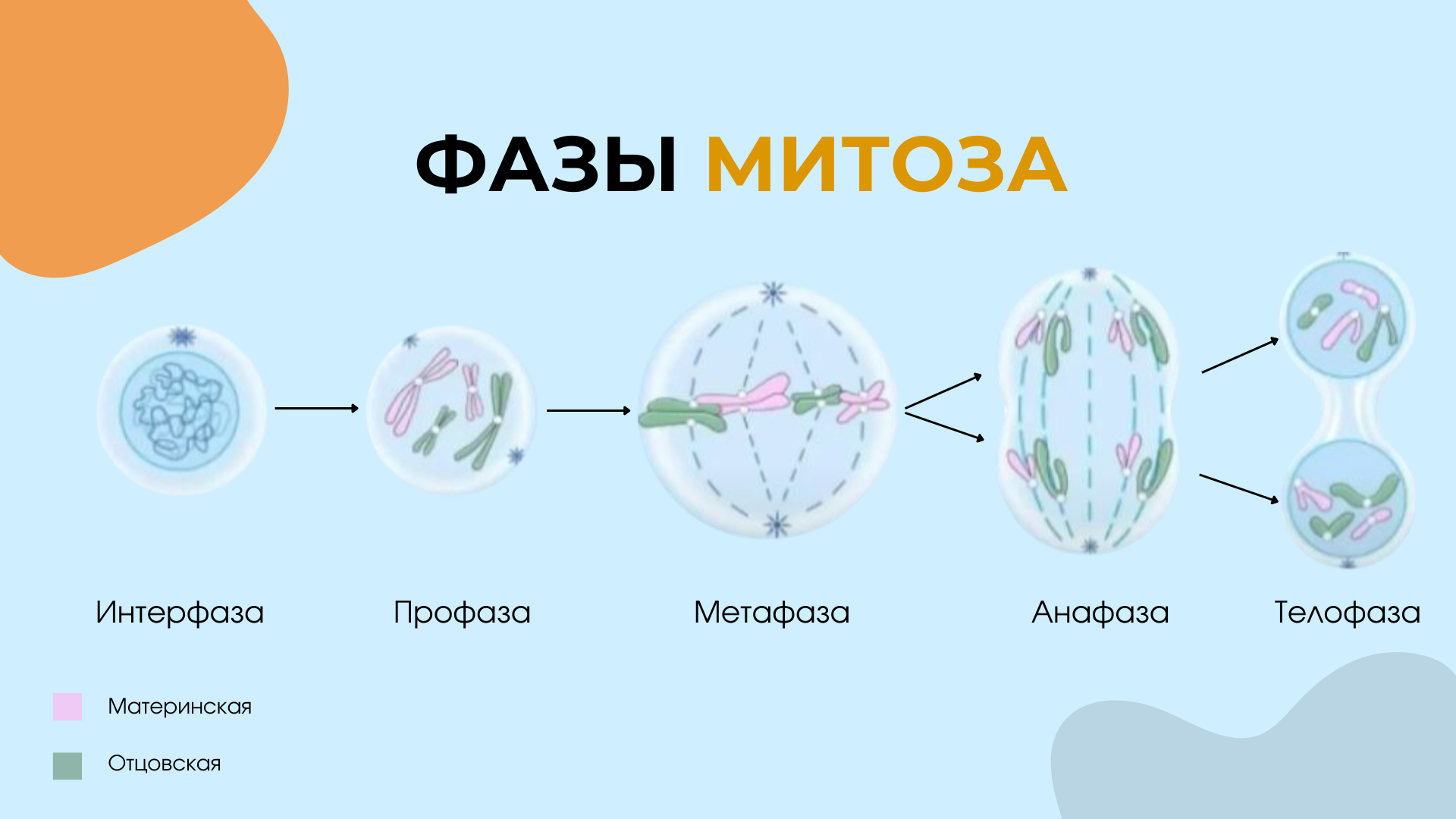
Фазы митоза рисунок

В зависимости от локализации различают несколько типов центромер. Ядро в клетках с крупной центральной вакуолью обычно располагается на периферии. К поздней профазе на каждой центромере сестринских хроматид формируются зрелые кинетохоры, необходимые хромосомам для присоединения к микротрубочкам веретена деления в прометафазе [48]. Хромосомы расположены так, что их центромеры находятся в плоскости экватора клетки.
При этом дольше всего сохраняются микротрубочки в средней части веретена деления, которые образуют остаточное тельце Флемминга [69]. Окончание телофазы преимущественно совпадает с разделением тела материнской клетки — цитокинезом цитотомией [70] [71]. При этом образуются две или более дочерние клетки. Процессы, ведущие к разделению цитоплазмы, берут своё начало ещё в середине анафазы и могут продолжаться после завершения телофазы.
Различают два основных типа цитокинеза: деление поперечной перетяжкой клетки наиболее характерно для клеток животных и деление путём образования клеточной пластинки свойственно растениям в связи с наличием жёсткой клеточной стенки. Плоскость деления клетки детерминируется положением митотического веретена и проходит под прямым углом к длинной оси веретена [72].
При делении поперечной перетяжкой клетки место разделения цитоплазмы закладывается предварительно ещё в период анафазы, когда в плоскости метафазной пластинки под мембраной клетки возникает сократительное кольцо из актиновых и миозиновых филаментов.
В дальнейшем, вследствие активности сократительного кольца, образуется борозда деления, которая постепенно углубляется вплоть до полного разделения клетки. По окончании цитокинеза сократимое кольцо полностью распадается, а плазматическая мембрана стягивается вокруг остаточного тельца Флемминга, состоящего из скопления остатков двух групп полюсных микротрубочек, тесно упакованных вместе с материалом плотного матрикса [73].
Деление путём образования клеточной пластинки начинается с перемещения мелких ограниченных мембраной пузырьков по направлению к экваториальной плоскости клетки. Здесь они сливаются, образуя дисковидную, окружённую мембраной структуру — раннюю клеточную пластинку. Мелкие пузырьки происходят в основном из аппарата Гольджи и перемещаются к экваториальной плоскости вдоль остаточных полюсных микротрубочек веретена деления, образующих цилиндрическую структуру, называемую фрагмопластом.
По мере расширения клеточной пластинки микротрубочки раннего фрагмопласта попутно перемещаются к периферии клетки, где за счёт новых мембранных пузырьков продолжается рост клеточной пластинки вплоть до её окончательного слияния с мембраной материнской клетки. После окончательного разделения дочерних клеток в клеточной пластинке откладываются микрофибриллы целлюлозы , завершая образование жёсткой клеточной стенки [74].
Протеолиз лежит в основе необратимых событий митоза, таких как разделение сестринских хроматид в анафазе или разрушение митотических циклинов на поздних стадиях митоза. Рассматривая вопрос регуляции митоза, можно условно выделить два периода митотического деления: от начала профазы до анафазы, и далее, от анафазы до конца телофазы [77].
Каждый из двух обозначенных периодов начинается с прохождения контрольной точки клеточного цикла. Первой контрольной точкой является переход из фазы G 2 к M-фазе. События от начала профазы и до окончания метафазы инициируются и протекают при участии белковых комплексов, состоящих из митотических циклинов и циклин-зависимых киназ англ.
Вторая контрольная точка служит разделительным барьером на границе метафазы и анафазы. На этом этапе критичным показателем является состояние веретена деления: вступление в анафазу у всех эукариот блокируется в случае наличия дефектов веретена. Ключевым активатором событий анафазы является убиквитинлигаза APC Cdc20 [76].
Ключевыми активаторами митоза, обеспечивающими инициацию событий профазы—метафазы, являются циклин-киназные комплексы англ. Эти комплексы представляют собой гетеродимеры, состоящие из двух субъединиц: регуляторной — митотического циклина англ.
M cyclin и каталитической — циклин-зависимой киназы англ. Cdk — cyclin-dependent kinase. В регуляцию митоза у всех эукариот вовлечена циклин-зависимая киназа Cdk1 [79] , которая представляет собой фермент фосфорилазу , модифицирующий белки за счёт переноса фосфатной группы от АТФ на аминокислоты серин и треонин.
Концентрация Cdk1 постоянна на протяжении всего клеточного цикла [80] , поэтому активность циклин-зависимой киназы в процессе митоза зависит главным образом от её соединения с митотическим циклином. Концентрация митотических циклинов увеличивается по мере приближения к митозу и достигает максимума в метафазе. Различным таксонам свойственны различные митотические циклины. Так, у почкующихся дрожжей в регуляцию митоза вовлечены четыре циклина Clb1, 2, 3 и 4; у дрозофилы — циклины A, B, B3; у позвоночных — циклин B [81].
Накопление митотических циклинов начинается ещё на стадии G 2. Увеличение концентрации циклинов обеспечивается за счёт транскрипции соответствующих им генов [83]. Новосинтезированные циклины сразу объединяются с неактивной киназой Cdk1. Однако образующиеся при этом циклин-киназные комплексы сохраняются в неактивном состоянии до момента активации митоза. Сдерживание активности комплексов M-Cdk1 на протяжении фазы G 2 осуществляется благодаря ингибирующему фосфорилированию молекулы Cdk1 [84].
За ингибирование Cdk1 ответственна группа протеинкиназ семейства Wee1 [81] [83]. В итоге, к началу митоза в клетке накапливается значительное количество неактивных комплексов M-Cdk1.
Собственно начало профазы на молекулярном уровне знаменуется резкой активацией киназных комплексов M-Cdk1. В основе скачкообразного увеличения активности M-Cdk1 лежат как минимум два взаимосвязанных события. Во-первых, к началу профазы приурочена активация фосфатаз семейства Cdc25, которые освобождают комплекс M-Cdk1 от ингибирующих фосфатных групп.
Во-вторых, активированные таким образом киназы M-Cdk1 включаются в цепочку положительной обратной связи : путём фосфорилирования они активируют собственных активаторов семейства Cdc25 и ингибируют собственных ингибиторов семейства Wee1.
В итоге, в начале профазы наблюдается взаимосвязанное увеличение активности фосфатаз семейства Cdc25 и циклин-киназ M-Cdk1 на фоне параллельного снижения активности ингибиторов семейства Wee1. Таким образом, в основу активации митоза заложен принцип положительной обратной связи. Помимо циклин-зависимых киназ в регуляцию митотических событий вовлечены как минимум ещё два типа киназ: polo-подобные киназы и киназы семейства aurora.
Polo-подобные киназы англ. Эти киназы вовлечены в различные митотические процессы: сборку веретена деления, функционирование кинетохора, цитокинез [87]. Киназы семейства aurora также относятся к группе серин-треониновых протеинкиназ. У многоклеточных выделяются два основных представителя этого семейства: aurora A и aurora B. Киназа aurora A участвует в регуляции функционирования центросом и митотического веретена. Киназа aurora B участвует в регуляции процессов конденсации и разделения сестринских хроматид, а также обеспечивает присоединение кинетохоров к микротрубочкам веретена деления [88].
Комплекс, стимулирующий анафазу англ. Функционально комплекс стимуляции анафазы представляет собой убиквитинлигазу и катализирует реакции присоединения молекул убиквитина к различным целевым белкам, которые в итоге подвергаются протеолизу [90].
В структуре комплекса стимуляции анафазы выделяется порядка 11—13 субъединиц. Функционирование комплекса регулируется за счёт присоединения активирующей субъединицы в нужный момент клеточного цикла [89]. Белок Cdc20 англ. Происходит это следующим образом. На стадии метафазы циклин-киназный комплекс M-Cdk путём фосфорилирования трансформирует ядро комплекса APC. В результате указанного конформационного изменения повышается вероятность присоединения активатора Cdc В итоге, активированный комплекс APC Cdc20 обретает убиквитин-лигазную активность и убиквитинирует свои главные цели — секьюрин и митотические циклины [89].
Секьюрин одна из главных мишеней APC Cdc20 представляет собой ингибирующий белок, сдерживающий в неактивном состоянии фермент сепаразу. Вследствие реакции убиквитинирования секьюрин разрушается, а высвободившаяся при этом сепараза разрушает когезин. После деградации когезина, обеспечивающего сцепление сестринских хроматид, происходит разделение и расхождение хромосом к полюсам деления клетки [91]. Убиквитинирование и, как следствие, разрушение митотических циклинов ещё одной важной мишени APC Cdc20 запускает цепочку отрицательной обратной связи.
Выглядит это следующим образом. Циклин-киназный комплекс M-Cdk активирует убиквитин-лигазный комплекс APC Cdc20 , который целенаправленно разрушает митотические циклины, что ведёт к деградации циклин-киназного комплекса M-Cdk, то есть цепочка реакций приводит к разрушению изначального активатора этой цепочки. В итоге APC Cdc20 деактивируется к концу митоза [89]. Митотический кроссинговер — процесс обмена участками гомологичных хромосом в процессе митотического деления.
Относительно редкий тип генетической рекомбинации в соматических клетках, по причине отсутствия нормального механизма конъюгации хромосом [92] [93]. Воздействие радиации или химических реагентов может повысить частоту митотической рекомбинации. Некоторые исследователи предполагают сходство механизмов мейотического и митотического кроссинговера [95].
Первые данные о существовании митотической рекомбинации были получены генетиком Куртом Штерном в году. Учёный проводил исследования на плодовых мушках и обратил внимание на локальное проявление рецессивных признаков у гетерозиготных особей.
То есть у мух с нормальным внешним покровом появлялись участки ткани с жёлтым окрасом или с «опалёнными» щетинками. Однако оба признака кодировались генами, локализованными в пределах одной хромосомы, и у гетерозиготных особей не должны были проявляться. Особо любопытны оказались случаи «двойных пятен», при которых проявлялись сразу оба рецессивных признака, причём у особей как женского, так и мужского пола.
В итоге, на основе полученных данных был сделан вывод о существовании митотической рекомбинации в соматических клетках [94] [95]. Патология митоза развивается при нарушении нормального течения митотического деления и зачастую приводит к возникновению клеток с несбалансированными кариотипами , следовательно, ведёт к развитию мутаций и анеуплоидии. Также в результате развития отдельных форм патологии наблюдаются хромосомные аберрации. Незавершённые митозы, прекращающиеся по причине дезорганизации или разрушения митотического аппарата, приводят к образованию полиплоидных клеток.
Полиплоидия и формирование дву- и многоядерных клеток возникают в случае нарушений механизмов цитокинеза. При значительных последствиях патологии митоза возможна гибель клетки. В нормальных тканях патология встречается в незначительных количествах. Частота патологических митозов также увеличивается с возрастом [99].
Условно различают патологию митоза функционального и органического типа. К функциональным нарушениям относят, например, гипореактивность вступающих в митоз клеток — снижение реакции на физиологические регуляторы, определяющие интенсивность пролиферации нормальных клеток. Органические нарушения возникают при повреждении структур, участвующих в митотическом делении хромосомы, митотический аппарат, клеточная поверхность , а также при нарушении процессов, связанных с этими структурами репликация ДНК, образование веретена деления, движение хромосом, цитокинез [99].
На основании морфологических признаков и цитохимических нарушений митотического процесса выделяют три основных группы патологий митоза: патология, связанная с повреждением хромосом; патология, связанная с повреждением митотического аппарата; нарушение цитокинеза []. Например, воздействие колхицина приводит к гиперспирализации хромосом, которые приобретают укороченную и утолщенную форму [].
Обозначенная патология наблюдается, к примеру, при изменении осмотического давления в фибробластах кролика в культуре ткани или же при воздействии канцерогенов бензпирена , метилхолантрена на мышиные фибробласты [].
Фрагменты могут быть одиночными, парными и множественными. Те из них, которые лишены центромерного участка, не участвуют в метакинезе, и, соответственно, не расходятся к полюсам деления в анафазе.
.svg/revision/latest/scale-to-width-down/340?cb=20150424155652&path-prefix=ru)
При массовой фрагментации хромосом пульверизация большинство фрагментов также беспорядочно рассеиваются в цитоплазме и не участвуют в метакинезе []. В итоге часть фрагментов хромосом может попасть в одно из дочерних ядер, либо резорбироваться, либо образовать обособленное микроядро. Также отдельные фрагменты обладают способностью воссоединяться своими концами, причём подобные воссоединения носят случайный характер и приводят к хромосомным аберрациям [].
При воссоединении фрагментов содержащих центромер образуется дицентрическая хромосома, которая в ходе анафазы растягивается между противоположными полюсами деления, образуя мост. Хромосомный обычно двойной мост возникает в результате воссоединения фрагментов хромосом, каждый из которых образован двумя хроматидами с центромерой. Хроматидный обычно одиночный мост возникает в результате воссоединения двух фрагментов отдельных хроматид с центромерой [].
К концу анафазы — в начале телофазы мосты обычно быстро рвутся в результате чрезмерного растягивания дицентрических фрагментов хромосом. Образование мостов приводит к генотипической разнородности дочерних клеток, а также нарушает течение завершающих стадий деления и задерживает цитокинез []. Поврежденные хромосомы пассивно «дрейфуют» в цитоплазме и в итоге либо разрушаются и элиминируются из клетки, либо случайным образом попадают в одно из дочерних ядер, либо образуют отдельное микроядро.
Отставание хромосом наблюдалось в культурах ткани опухолевых клеток, а также в экспериментах, в ходе которых кинетохоры хромосом облучались микропучком ультрафиолетовых лучей []. Новообразованные микроядра либо сохраняются в клетке в течение всего дальнейшего клеточного цикла вплоть до очередного деления, либо подвергаются пикнозу , разрушаются и выводятся из клетки [].
Вследствие набухания хромосомы теряют свои нормальные очертания и слипаются, превращаясь в комковатые массы. Расхождения хромосом не происходит и клетки в таком состоянии зачастую погибают []. В результате воздействия статмокинетических ядов митоз задерживается на стадии метафазы в связи с дезорганизацией различных компонентов митотического веретена деления — центриолей, микротрубочек, кинетохоров.
Повреждения также затрагивают клеточное ядро, плазмалемму, различные внутриклеточные органоиды митохондрии , хлоропласты , аппарат Гольджи. Действие статмокинетических ядов усиливает спирализацию хромосом, что приводит к их укорочению и утолщению, а порой доводит до набухания и слипания хромосом. Как следствие, происходят хромосомные аберрации, образуются микроядра в результате фрагментации или отставания хромосом, развивается анеуплоидия []. Исход к-митоза зависит от дозы и времени воздействия статмокинетического яда на делящуюся клетку.
При токсических дозах наблюдается пикноз ядра и гибель клетки. Значительные отравления приводят к полиплоидизации. Воздействие небольших доз обратимо. В течение нескольких часов может восстановиться митотический аппарат и продолжиться митотическое деление [].

В итоге хромосомы распределяются неравномерно между дочерними ядрами, что, в свою очередь, ведет к образованию анеуплоидных клеток с несбалансированным набором хромосом []. При этом формируется лишь один полюс, от которого расходятся нити единственного полуверетена. В итоге моноцентрический митоз приводит к полиплоидизации [].
В результате асимметричный митоз приводит к образованию микроклеток и гигантских клеток с гипо- и гиперплоидными ядрами. Хромосомы сохраняются вблизи полюсов веретена из-за отставания в процессе метакинеза, а не из-за преждевременного расхождения.
Причинами отставания могут служить повреждения кинетохора или дезорганизация отдельных хромосомальных нитей, участвующих в движении отстающих хромосом [].
Различают две группы патологий митоза, связанные с нарушением цитотомии: раннюю цитотомию , берущую начало ещё в анафазе; либо наоборот, запаздывание или полное отсутствие цитотомии , в результате чего формируются двуядерные клетки, либо образуется одно полиплоидное ядро [].
При этом отдельные варианты классификации, разработанные применительно к одним таксонам , являются неприемлемыми в отношении других, поскольку не учитывают специфики их митозов. Например, отдельные варианты классификации митозов, свойственных животным или растительным организмам, оказываются неприемлемыми для водорослей []. Одним из ключевых признаков, лежащих в основе различных типологий и классификаций митотического деления, является поведение ядерной оболочки.
Если образование веретена и само митотическое деление протекает внутри ядра без разрушения ядерной оболочки, то такой тип митоза называют закрытым. Митоз с распадом ядерной оболочки, соответственно, называется открытым , а митоз с распадом оболочки только на полюсах веретена, с образованием «полярных окон» — полузакрытым [] [].
Также при анализе митоза учитывают особенности веретена деления. При плевромитозе веретено деления состоит из двух полуверетён, располагающихся в метафазе-анафазе под углом друг к другу также под плевромитозом понимают митоз с боковым по отношению к ядру внеядерным веретеном.
Для ортомитоза характерно цельное веретено деления, а в метафазе зачастую наблюдается различимая экваториальная пластинка []. В рамках обозначенных признаков наиболее многочисленным является типичный открытый ортомитоз. Этот тип митоза характерен для животных, высших растений и некоторых простейших []. Предполагается, что сложный митотический процесс высших организмов развивался постепенно из механизмов деления прокариот [].
Это предположение подтверждается тем, что прокариоты появились приблизительно на миллиард лет раньше первых эукариот. Кроме того, в митозе эукариот и бинарном делении прокариот принимают участие схожие белки. Возможные промежуточные стадии между бинарным делением и митозом можно проследить у одноклеточных эукариот , у которых в ходе деления не разрушается ядерная мембрана. У большинства же других эукариот, в том числе растений и животных, веретено деления формируется вне ядра , а ядерная оболочка разрушается в течение митоза.
Хотя митоз у одноклеточных эукариот ещё недостаточно изучен, можно предположить, что он произошёл от бинарного деления и в конечном счёте достиг того уровня сложности, который имеется у многоклеточных организмов []. У многих простейших эукариот митоз также остался процессом, связанным с мембраной, однако теперь уже не плазматической , а ядерной [].
Возможно, в связи с увеличением размера и числа хромосом, структура типа мезосомы разделилась на два элемента: ЦОМТ на ядерной оболочке и кинетохор на хромосоме.
Для соединения этих структур между собой в процессе эволюции развилась промежуточная система микротрубочек. В рамках этого представления, наиболее древним и примитивным считается закрытый внутриядерный плевромитоз. Сегрегация хромосом при этом происходит путём расхождения ЦОМТ, к которым хромосомы крепятся посредством микротрубочек.
В свою очередь, ЦОМТ закреплены на ядерной оболочке и расходятся за счёт роста ядерной мембраны между ними []. От разных вариантов закрытого внутриядерного плевромитоза, вероятно, берут своё начало несколько параллельных эволюционных линий [].
В качестве эволюционно прогрессивных признаков при этом рассматриваются: распад ядерной оболочки во время митоза; переход ЦОМТ из ядра в цитоплазму; образование биполярного веретена; усиление спирализации хромосом; формирование экваториальной пластинки в метафазе. Таким образом, эволюция митотического деления идёт в направлении от закрытого внутриядерного плевромитоза к открытому ортомитозу [].
Эндомитоз представляет собой разновидность митоза без деления ядра или клетки , в результате чего в клетке накапливается множество копий одних и тех же хромосом , собранных в одном ядре. Этот процесс может также включать эндоредупликацию , а клетки в этом случае называются эндоплоидными [].
Примером клеток, подвергающихся эндомитозу, могут служить мегакариоциты , дающие начало тромбоцитам []. Крайним случаем эндомитоза является образование гигантских политенных хромосом , появляющихся как результат многократного воспроизведения хромосом без последующего расхождения. Такие хромосомы встречаются в слюнных железах некоторых насекомых , у личинок двукрылых в ядрах клеток кишечника и у некоторых растений в ядрах синергид например, гороха [].
Митоз является важным средством поддержания постоянства хромосомного набора. В результате митоза осуществляется идентичное воспроизведение клетки. Следовательно, ключевая роль митоза — копирование генетической информации.
Материал из Википедии — свободной энциклопедии. Это стабильная версия , отпатрулированная 12 октября Митоз ядер эмбриона дрозофилы фруктовой Drosophila melanogaster Раковые клетки человека HeLa.
Ядро особенно ДНК подсвечено голубым цветом. Клетки в центре и справа находятся в интерфазе. Основная статья: Веретено деления. Основная статья: Микротрубочки. Основные статьи: Центромера и Кинетохор. Основная статья: Препрофаза. Основная статья: Профаза. Основная статья: Прометафаза. Основная статья: Метафаза. Основная статья: Анафаза. Основная статья: Телофаза. Основная статья: Цитокинез. Основная статья: Митотический кроссинговер. Основная статья: Эндомитоз. Например, в раннем эмбриогенезе млекопитающих при делении созревания ооцита и при I и II делении зиготы наблюдаются бесцентриолярные анастральные митозы.
Такое стабилизированное веретено не может тянуть хромосомы, и митоз останавливается. Но митоз блокируется и при прямо противоположном воздействии, если нити веретена обратимо разрушить с помощью одного из трех агентов, подавляющих сборку тубулина в микротрубочки, — колхицина, низкой температуры или высокого гидростатического давления [49].
По одной из них перемещение хроматид объясняется наличием в кинетохоре «шагающих» белков, сходных по своей природе с динеином или кинезином; они продвигаются по микротрубочке, используя для этого энергию гидролиза АТФ.
По другой гипотезе движение хромосом обусловлено распадом микротрубочек: по мере того как субъединицы тубулина диссоциируют, кинетохор, чтобы сохранить связь с микротрубочкой, должен скользить в направлении полюса. Третья возможность состоит в том, что микротрубочки не ответственны прямо за возникновение силы, движущей кинетохор к полюсам, а просто регулируют движение, вызываемое какой-то другой структурой [63]. Так, в эндосперме многих растений протекают множественные митозы без деления цитоплазмы, что приводит к образованию многоядерного симпласта.
Аналогичная ситуация наблюдается при синхронных делениях многочисленных ядер миксомицетов , или на ранних этапах развития зародышей некоторых насекомых [70].
Например, предполагается, что комплексы M-Cdk1 не полностью блокируются семейством ингибиторов Wee1. В результате, пропорционально увеличению концентрации митотических циклинов, к началу профазы может накопиться критическая масса активных киназ M-Cdk1.
Частичная активация циклин-киназ у позвоночных, возможно, обеспечивается фосфатазой Cdc25B, уровень активности которой возрастает с поздней S-фазы и достигает максимума в профазе митоза. Однако было продемонстрировано, что мышиные клетки способны делиться в отсутствие этого стимула. Ещё одним возможным активатором может быть комплекс циклин A-Cdk, сохраняющий свою активность с начала S-фазы вплоть до конца прометафазы митоза [85]. The diversity of forms of mitosis in protozoa: A comparative review англ.
Mitosis, not just open or closed неопр. A dictionary of genetics. Schneider, Friedrich Anton англ. Дата обращения: 25 апреля Архивировано 26 апреля года. Архивировано из оригинала 11 февраля года.
Division Plane Determination in Plant Cells англ. Архивировано 25 февраля года. Архивировано из оригинала 26 апреля года.
New insights into cell cycle control from the Drosophila endocycle англ. Megakaryocytes and beyond: the birth of platelets англ. Медиафайлы на Викискладе. Ссылки на внешние ресурсы. Большая датская Большая каталанская Большая советская 1 изд. Ларусса Britannica онлайн Treccani Universalis Гранат. Клеточный цикл. G 1 -фаза S-фаза G 2 -фаза. G 0 -фаза Апоптоз Мейоз.
Точка рестрикции Точка веретена Пострепликационная точка Биохимические переключатели в клеточном цикле. Комплекс стимуляции анафазы Комплекс SCF.
Аутосома Гоносома Микрохромосома Политенные хромосомы Хромосомы типа ламповых щёток. Когезин Сестринские хроматиды Синаптонемный комплекс Хиазма. Эухроматин Гетерохроматин. Клетки, которые прошли дифференцировку и больше не делятся, постоянно находятся в фазе покоя G 0.
При стимуляции митогенами например, ростовыми факторами, онкогенными вирусами покоящиеся клетки могут вернуться в состояние, свойственное фазе G 1. ЕСЛИ такие клетки пройдут критическую точку, они вступают в S-фазу. G 2 -фаза является конечным этапом подготовки клетки к делению. В совокупности фазы G 1 , G 0 , S и G 2 носят название интерфазы. В клеточном цикле интерфаза сменяется существенно более короткой фазой митоза М. В активной форме фермент катализирует фосфорилирование многих белков, принимающих участие в митозе, таких, например, как входящий в состав хроматина гистон H1 см.
Фосфорилирование этих белков запускает процесс митоза. После завершения митоза регуляторная субъединица ФС, циклин, маркируется убиквитином и подвергается протеолизу см. Теперь наступает очередь протеинфосфатаз, которые дефосфори пируют белки, принимавшие участие в митозе, после чего клетка возвращается в состояние интерфазы. ФС — гетеродимерный фермент, включающий регуляторную субъединицу, циклин , и каталитическую субъединицу, циклинзависимую киназу [ ЦЗК CDK от англ. Кроме того, активность протеинкиназы регулируется путем обратимого фосфорилирования самого фермента на схеме представлен предельно простой вариант этого процесса.